
La cardio-oncología es un trabajo multidisciplinario y de su correcta integración depende el éxito de su abordaje. La implementación de un programa de cardio-oncología en las instituciones permite ahorros principalmente de tiempo, para evitar interrupciones en las intervenciones, pero sobre todo para evitar la aparición de toxicidad cardiovascular relacionada con el tratamiento del cáncer (CTR-CVT).
¿Cómo se manifiesta la CTR-CVT?
Una de las complicaciones de la toxicidad cardiovascular relacionada con el tratamiento del cáncer (CTR-CVT) es la falla cardíaca. En la tabla 1 se observa una clasificación propuesta por Urban, S. Et al. 2022 por fenotipos basados en alteraciones fisiopatológicas y caracterización clínica, la cual se suma a las clasificaciones de falla cardiaca según:
- La fracción de eyección
- La severidad de los síntomas y actividad física
Lee también: Tipos de cáncer más prevalentes y con mayor impacto en Colombia
Tabla 1. Clasificación de la falla cardíaca por fenotipos basados en alteraciones fisiopatológicas y caracterización clínica (Urban 2022)
| Grupo | Característica clínica clave |
| Grupo 0 | Más bajo porcentaje de FC crónica, edema de miembros inferiores más masivo, urea en orina más alta, k, creatinina, ferritina más alta, % más alta de NYHA I, más bajo % con antecedentes de accidente cerebrovascular, mejor pronóstico: % más alto de Falla Cardíaca (FC) de novo, con función renal conservada. |
| Grupo 1 | Mayor % de mujeres que en el resto de la población, mayor presión sistólica, mayor hipertensión, diabetes, enfermedad pulmonar obstructiva crónica y antecedentes de accidente cerebrovascular (TFG más baja, creatinina, urea y potasio en orina más bajos, NTproBNP más bajo), congestión pulmonar más masiva y menos edema periférico masivo, mayor etiología de hipertensión, mejor pronóstico: hipertensos, pacientes diabéticos con aterosclerosis avanzada y comorbilidades, función renal disminuida, población anciana con una parte importante de FC de novo. |
| Grupo 2 | Pacientes más jóvenes, NYHA y fracción de eyección bajas, presión arterial, troponina, CRP e IL-6 más bajas, % más bajo de antecedentes de diabetes, % más bajo de antecedentes y etiología de CAD, etiología de hipertensión más baja, etiología "otra" más alta, TFG más alta, NTproBNP, bilirrubina , Alt, Ast, mayor % de fumadores activos, menor congestión pulmonar masiva, mejor pronóstico—jóvenes "saludables", en etapa temprana, presunta etiología tóxica. |
| Grupo 3 | Valor más bajo de glóbulos blancos, ferritina, sodio urinario, Tsat, lactatos, troponina más alta, INR, albúmina, % más alto de HFrEF e HF crónica, % más alto de antecedentes de enfermedad valvular, % más alto de congestión pulmonar (97 %), pronóstico medio: HFrEF con recursos reducidos de hierro. |
| Grupo 4 | Predominantemente hombre, pH, creatinina, urea, lactatos más altos, fracción de eyección y pCO2 más bajas, porcentaje más alto de ascitis y hepatomegalia, JVP más masiva, etiología más alta de CAD, peor pronóstico: hombres, HFrEF, con síndrome cardiorrenal, hiperventilación, insuficiencia ventricular derecha. |
| Grupo 5 | FE más alta, sin antecedentes de CAD (0 %), población más antigua, `)/0 más altademujeres, CRP más alto, IL6, peso corporal más bajo, % bajo de MI/PCl/CABG, peor pronóstico—HFpEF fenotipo con aumentomarcadores inflamatorios. |
|
*HFrEF: Falla cardíaca con fracción de eyección reducida *HFpEF: Falla cardíaca con fracción de eyección preservada |
|
La CTR-CVT comprende una serie de efectos que se pueden evidenciar a nivel cardiaco y vascular. En la tabla 2, se observan las principales manifestaciones y su respectiva clasificación.
Tabla 2. Grupos de enfermedades descritas para CTR-CVT
|
Disfunción cardíaca asociada al tratamiento del cáncer (CTRCD) |
|||
|
Sintomática (falla cardíaca) |
Muy severa |
Falla cardíaca que requiere soporte inotrópico, soporte circulatorio mecánico o hasta trasplante. |
|
|
Severa |
Falla cardíaca que requiere hospitalización. |
||
|
Moderada |
Requiere aumento en dosis y frecuencia de terapia con diuréticos y de otras terapias para falla cardíaca en ambiente ambulatorio. |
||
|
Leve |
Síntomas de falla cardíaca leves, no requieren cambios en tratamiento. |
||
|
Asintomática |
Severa |
Nueva reducción en la fracción de eyección del ventrículo izquierdo inferior (FEVI) al 40% |
|
|
Moderada |
Nueva reducción de la FEVI en ≥10 puntos porcentuales a una FEVI de 40–49% O Nueva reducción de la FEVI en <10 puntos porcentuales a una FEVI de 40–49 % Y una nueva disminución relativa en el strain longitudinal global (GLS) de 0,15 % desde el punto de referencia. O nuevo aumento en biomarcadores cardíacos |
||
|
Leve |
FEVI ≥50% Y nueva disminución relativa en GLS en un 0,15 % desde el punto de referencia Y/O nuevo aumento de biomarcadores cardíacos. |
||
|
Miocarditis asociada a inhibidores del sistema de control inmune |
|||
|
Diagnóstico histopatológico |
Infiltrados de células inflamatorias multifocales con pérdida manifiesta de cardiomiocitos por microscopía óptica |
||
|
Diagnóstico clínico |
Elevación de Troponina cardíaca cTn (cambio nuevo o significativo desde el inicio) con 1 criterio mayor o 2 criterios menores, después de la exclusión de síndrome coronario agudo (SCA) y miocarditis infecciosa aguda con base en la sospecha clínica. |
||
|
Criterio mayor: • Diagnóstico por RMN cardíaca para miocarditis aguda (criterios de Lake Louise modificados) |
|||
|
Criterios menores: • Síndrome clínico (incluyendo cualquiera de los siguientes: fatiga, mialgias, dolor torácico, diplopía, ptosis, dificultad para respirar, ortopnea, edema en las extremidades inferiores, palpitaciones, aturdimiento/mareos, síncope, debilidad muscular, shock cardiogénico) • Arritmia ventricular (incluyendo paro cardíaco) y/o nueva enfermedad del sistema de conducción • Disminución de la función sistólica del VI, con o sin anomalías regionales del movimiento de la pared en un paciente con un patrón no Takotsubo • Otros eventos adversos relacionados con el sistema inmunitario, en particular miositis, miopatía, miastenia grave • RMN cardíaca sugestiva |
|||
|
Severidad de la miocarditis |
Fulminante |
Inestabilidad hemodinámica, falla cardiaca que requiere ventilación no invasiva o invasiva, bloqueo cardíaco completo o de alto grado y/o arritmia ventricular significativa. |
|
|
No fulminante |
Incluye pacientes sintomáticos pero hemodinámica y eléctricamente estables y casos incidentales diagnosticados al mismo tiempo que otros eventos adversos inmunorelacionados. Los pacientes pueden tener FEVI reducida pero sin características de enfermedad grave. |
||
|
Refractaria a esteroides |
Miocarditis que no se resuelve o empeora (empeoramiento clínico o elevación persistente de troponina después de la exclusión de otras etiologías) a pesar de dosis altas de metilprednisolona. |
||
|
Recuperación de la miocarditis |
Completa |
Pacientes con resolución completa de los síntomas agudos, normalización de biomarcadores y recuperación de la FEVI después de suspender la inmunosupresión. El RMN cardíaco aún puede mostrar LGE o T1 elevado debido a la fibrosis, en ausencia de edema agudo. |
|
|
En recuperación |
Mejora continua en los síntomas clínicos, signos, biomarcadores y parámetros de imágenes del paciente, pero aún no normalizados, mientras se reducen las dosis de inmunosupresión. |
||
|
Toxicidad vascular |
|||
|
Asintomática |
Enfermedad de arterias coronarias, enfermedad de arterias periféricas, enfermedad de arteria carótida, trombosis venosa o arterial, vasorreactividad periférica, vasorreactividad epicárdica coronaria y vasorreactividad microvascular coronaria. |
||
|
Sintomática |
Accidente cerebrovascular, ataque isquémico transitorio, infarto al miocardio, síndrome coronario agudo, síndrome coronario crónico, enfermedad de arterias periféricas, angina vasoespástica, angina microvascular y fenómeno de Raynaud. |
||
|
Hipertensión arterial |
|||
|
Umbral de tratamiento para la hipertensión antes, durante y después de la terapia |
En pacientes de alto riesgo CV: ≥130 mmHg sistólica y/o ≥80 mmHg diastólica Bajo riesgo CV: ≥140 mmHg sistólica y/o ≥90 mmHg diastólica |
||
|
Umbral de mantenimiento de la terapia contra el cáncer |
≥180 mmHg sistólica y/o ≥110 mmHg diastólica. |
||
|
Emergencia hipertensiva |
Disminución inmediata para reducir o prevenir daño en órgano diana. |
||
|
Arritmias cardíacas |
|||
|
Prolongación segmento QT |
Prolongado: QTcF >500 ms |
||
|
Otras |
Bradicardia, taquicardia supraventricular, arritmias ventriculares y fibrilación auricular. |
||
¿Cómo prevenir la CTR-CVT?
Prevención cardiovascular en pacientes con cáncer
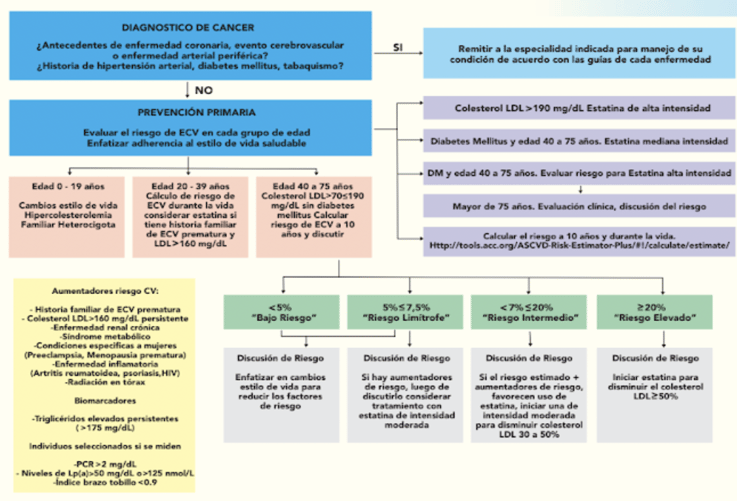
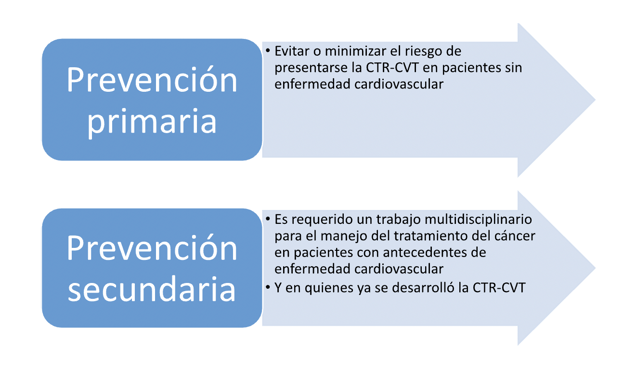
El monitoreo cardíaco es importante para el adecuado seguimiento del paciente durante el tratamiento del cáncer, dentro del cual se incluyen por lo menos:
- Ecocardiografía 3D
- Strain longitudinal global (GLS)
- Biomarcadores cardíacos
Estos permitirán detectar la toxicidad cardiovascular de base y la posible aparición en presencia de determinados tratamientos para el cáncer.
Vea el esquema de las vías de cuidado que se recomienda tener en el programa de cardio-oncología según el nivel del riesgo del paciente y a lo largo del tiempo del tratamiento del cáncer.
¿Cómo hacer el adecuado seguimiento del paciente según cada etapa del tratamiento del cáncer?
Según la ruta del paciente, veamos ahora el antes, durante y después del manejo con el programa de cardio-oncología del paciente en tratamiento de cáncer.
Antes
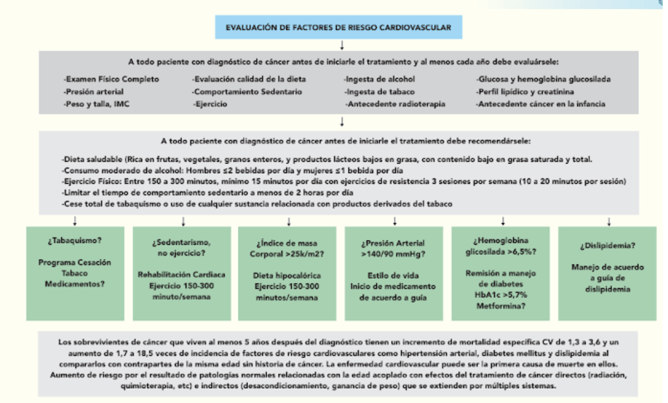
- Se recomienda llevar a cabo una lista de chequeo que permita valorar el riesgo que tiene el paciente.(Clase I)
- Se recomienda usar la estratificación del riesgo de toxicidad cardiovascular basal de la HFA-ICOS Heart Failure Association–International Cardio-Oncology Society (Clase IIa).
a. ¿Qué se hace con el resultado de esta estratificación? - Se recomienda hacer un tamizaje basal para los pacientes que en su tratamiento del cáncer recibirán medicamentos potencialmente cardiotóxicos. (Clase I, Clase IIa y Clase IIb).
Durante
- Se recomienda seguir protocolos de vigilancia según el tratamiento de cáncer, en todos los casos la ecocardiografía transtorácica (ECO-TT), el electrocardiograma (EKG), y el péptido natriurético (NP) son recomendadas para el seguimiento de estos pacientes; otros exámenes paraclínicos y de imagenología son de uso específico en determinados tratamientos.
- El riesgo de tromboembolismo venoso en pacientes en tratamiento del cáncer con/sin fibrilación auricular es fundamental a tener en cuenta en el abordaje y cuidado de los pacientes.
Después
Cuando se presente la toxicidad cardiovascular relacionada con el tratamiento del cáncer, se debe proceder a diagnosticar y a un manejo adecuado de la misma. Veamos a continuación el diagnóstico y manejo de:
- Disfunción cardíaca relacionada con antraciclinas
- Disfunción cardíaca relacionada con terapia anti-HER2
- Diagnóstico definitivo de miocarditis por inhibidores del sistema de control inmune
- Síndrome de Takotsubo relacionado con cáncer
- Arritmias cardíacas, con foco en monitorear el segmento QTc antes y durante el tratamiento del cáncer
- Hipertensión arterial
Una vez el tratamiento del cáncer finalice, el equipo de cardio-oncología deberá coordinar un seguimiento a largo plazo del paciente, que permita detectar y manejar ante la aparición o continuar la recuperación de la toxicidad cardiovascular que se pueda presentar. En todo caso, es muy importante involucrar al paciente y sus familias o cuidadores para que adopten estilos de vida saludable, pero además para que estén en la capacidad de reconocer y alertar ante signos y síntomas de disfunción cardiovascular.
¿Te interesa ahondar en información sobre dislipidemia e hipertensión?
Referencias
- Lyon AR, López-Fernández T, Couch LS, et al; ESC Scientific Document Group. 2022 ESC Guidelines on cardio-oncology developed in collaboration with the European Hematology Association (EHA), the European Society for Therapeutic Radiology and Oncology (ESTRO) and the International Cardio-Oncology Society (IC-OS). Eur Heart J Cardiovasc Imaging. 2022 Aug 26:jeac106.
- Urban S, Błaziak M, Jura M, et al. Novel Phenotyping for Acute Heart Failure-Unsupervised Machine Learning-Based Approach. Biomedicines. 2022 Jun 27;10(7):1514.
- McDonagh TA, Metra M, Adamo M, et al; ESC Scientific Document Group. 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure. Eur Heart J. 2021 Sep 21;42(36):3599-3726.
- Agewall, S., Giannitsis, E., Jernberg, T., & Katus, H. (2010). Troponin elevation in coronary vs. non-coronary disease. European Heart Journal, 32(4), 404–411.
- Angeli F, Reboldi G, Trapasso M, Gentile G, Pinzagli MG, Aita A, Verdecchia P. European and US guidelines for arterial hypertension: similarities and differences. Eur J Intern Med. 2019 May;63:3-8.
- Giraud EL, Ferrier KRM, Lankheet NAG, Desar IME, Steeghs N, Beukema RJ, van Erp NP, Smolders EJ. The QT interval prolongation potential of anticancer and supportive drugs: a comprehensive overview. Lancet Oncol. 2022 Sep;23(9):e406-e415.
- Sociedad colombiana de cardiología. 2020. Folleto de cardio-oncología “Ciencia con corazón”.
.png?width=200&height=63&name=Logo%20Legrand%20NUEVO%20(png).png)

.jpeg?width=369&height=250&name=Trombocitemia%20Esencial%20(1).jpeg)
.jpeg?width=369&height=250&name=Enfermedades%20aorticas%20(1).jpeg)
