.webp?width=1060&height=504&name=C%C3%A1ncer%20(1).webp)
Las células madre cancerosas, también conocidas como células madre tumorales, son un subconjunto de células cancerosas con la capacidad de autorrenovación y diferenciación hacia células hijas que forman el tumor.1
Se cree que estas células surgen a partir de células madre normales o células progenitoras, que adquieren mutaciones genéticas y/o epigenéticas que les confieren características cancerosas. Estas células madre cancerosas son responsables de la resistencia a los tratamientos y la recaída del cáncer después del tratamiento, lo que hace que su eliminación sea una estrategia clave en la lucha contra el cáncer. El estudio de la génesis de las células madre cancerosas es fundamental para entender mejor su biología y, en última instancia, para desarrollar terapias más eficaces contra el cáncer.1,2,3 A hoy se conoce que las células madre cancerosas (CSC) pueden tener diferentes orígenes. Ver figura 1.4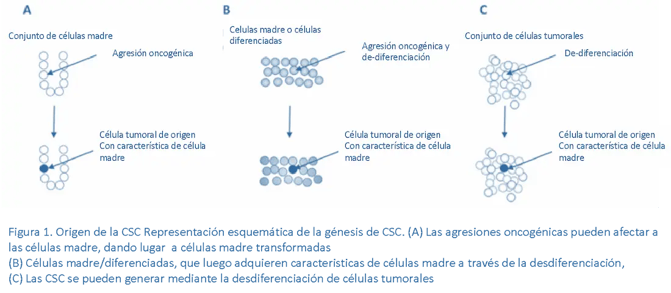
Plasticidad de las células tumorales
Varias líneas de evidencia respaldan la hipótesis de que las células cancerosas son entidades altamente plásticas que pueden cambiar entre diferentes estados. No solo las CSC son entidades plásticas que pueden generar células tumorales masivas más diferenciadas, sino que las células tumorales masivas también pueden sufrir un proceso de desdiferenciación que conduce a la formación de CSC (figura 1-C), el mismo que hace que las células somáticas transformadas adquieran características de células madre.4
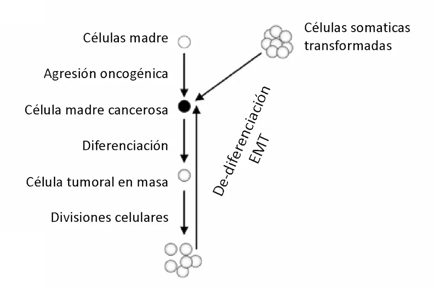
Figura 2. Plasticidad de las células cancerosas a través de EMT.
Una de las formas más conocidas en que las células cancerosas muestran plasticidad es a través de la transición epitelio-mesénquima (EMT, por sus siglas en inglés). Durante la EMT, las células cancerosas adquieren características de células mesenquimales, como la capacidad de migrar y diseminarse a través del cuerpo. Estas células también pierden sus características epiteliales, como la adhesión celular y la polaridad, lo que les permite invadir los tejidos circundantes y diseminarse a través de la circulación sanguínea o linfática. La EMT también se ha asociado con una mayor resistencia a la terapia, lo que puede dificultar el tratamiento del cáncer.4
Tal vez quieras seguir leyendo: Tipos de cáncer más prevalentes y con mayor impacto en Colombia
Otra forma en que las células cancerosas muestran plasticidad es a través de la transición mesénquima-epitelio (MET, por sus siglas en inglés). Durante la MET, las células cancerosas pueden recuperar características epiteliales, como la adhesión celular y la polaridad, lo que les permite formar colonias tumorales y crecer en un lugar específico. La MET también puede estar involucrada en la resistencia a la terapia, ya que las células pueden cambiar su fenotipo en respuesta a los tratamientos.5
Además de la EMT y la MET, las células cancerosas también pueden mostrar plasticidad a través de la expresión de diferentes marcadores celulares, la activación de vías de señalización y la modificación de su microambiente, lo que hace que en algunos tipos de tumores y específicamente en los estadios más avanzados se hagan más resistentes a los tratamientos.2,5
Lee también: Recomendaciones en cardio-oncología
Si quieres ser conferencista o mejorar tu desempeño como uno, descarga esta guía para que encuentres algunos consejos y trucos para lograr lo que todo speaker busca: ser memorable.
Referencias
- Babaei G, Aziz SG, Jaghi NZZ. EMT, cancer stem cells and autophagy; The three main axes of metastasis. Biomed Pharmacother. 2021 Jan;133:110909.
- Walcher L, Kistenmacher AK, Suo H, et al. Cancer Stem Cells-Origins and Biomarkers: Perspectives for Targeted Personalized Therapies. Front Immunol. 2020 Aug 7;11:1280.
- Nassar D, Blanpain C. Cancer Stem Cells: Basic Concepts and Therapeutic Implications. Annu Rev Pathol. 2016 May 23;11:47-76.
- Chiodi I, Mondello C. Life style factors, tumor cell plasticity and cancer stem cells. Mutat Res Rev Mutat Res. 2020 Apr-Jun;784:108308.
- Nachiyappan A, Gupta N, Taneja R. EHMT1/EHMT2 in EMT, cancer stemness and drug resistance: emerging evidence and mechanisms. FEBS J. 2022 Mar;289(5):1329-1351.
.png?width=200&height=63&name=Logo%20Legrand%20NUEVO%20(png).png)

.jpeg?width=369&height=250&name=Histonas%20(1).jpeg)

