
La disbiosis intestinal asociada al uso de antibióticos es una preocupación creciente en el campo médico.
En todo el mundo, el uso excesivo e indiscriminado de antibióticos ha llevado a un aumento de las enfermedades intestinales y a un aumento de la resistencia bacteriana. Como médicos, es importante entender el impacto de los antibióticos en la microbiota intestinal y cómo se puede prevenir y tratar la disbiosis.
El uso de antibióticos en todo el mundo sigue aumentando. Según la Organización Mundial de la Salud, el consumo de antibióticos ha aumentado en un 65% en los últimos 15 años. Este aumento ha llevado a una mayor tasa de resistencia bacteriana, lo que significa que las infecciones son más difíciles de tratar.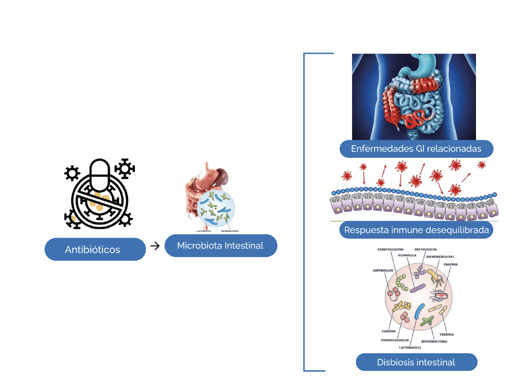
Gráfica 1. Alteraciones intestinales derivadas del uso de antibióticos
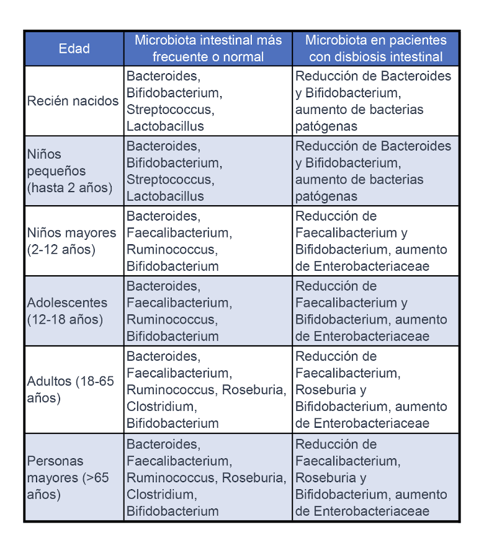
Tabla 1. Especies de microbiota normal y en disbiosis según grupo etario
Especies de microbiotas según grupo etario
La composición de la microbiota intestinal varía según la edad. En neonatos y lactantes, predominan especies como Bifidobacterium y Lactobacillus, fundamentales para el desarrollo del sistema inmunológico. En adultos, la microbiota es más diversa e incluye Bacteroides, Firmicutes y Proteobacteria. En personas mayores, se observa una disminución de Bifidobacterium y un aumento de bacterias proinflamatorias, lo que puede predisponer a enfermedades gastrointestinales.
Los antibióticos alteran este equilibrio en diferentes grados según el grupo etario. En lactantes, pueden afectar el desarrollo del sistema inmunológico, mientras que en adultos y ancianos pueden aumentar la susceptibilidad a infecciones y enfermedades inflamatorias intestinales.
Antibióticos que más producen disbiosis intestinal
Algunos antibióticos son más propensos a causar disbiosis intestinal que otros, y es importante que los médicos estén informados sobre cuáles son estos antibióticos y sus efectos. Según un estudio publicado en la revista Clinical Infectious Diseases, los diez antibióticos que más frecuentemente producen disbiosis son: clindamicina, cefixima, cefuroxima, cefpodoxima, ácido clavulánico/amoxicilina, ampicilina, cefaclor, amoxicilina, ceftriaxona y levofloxacino.
Estos diez antibióticos representaron el 75% de los casos de diarrea asociada a antibióticos en el estudio. Aunque todos los antibióticos tienen el potencial de alterar la microbiota intestinal y causar disbiosis, algunos parecen tener un menor impacto que otros. Por ejemplo, los macrólidos como la azitromicina y la eritromicina parecen tener un riesgo menor de causar disbiosis en comparación con otros antibióticos. Además, los antibióticos que se dirigen a infecciones específicas, como la nitrofurantoína para infecciones urinarias y la vancomicina para infecciones graves por Staphylococcus aureus, también parecen tener un riesgo menor de causar disbiosis intestinal debido a que se utilizan durante un período de tiempo más corto y se dirigen a un grupo específico de bacterias.
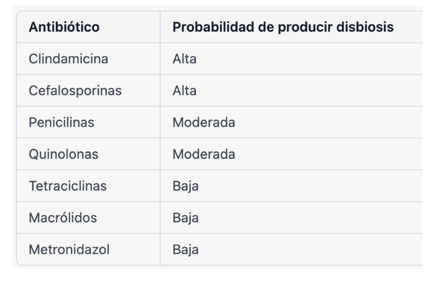
Tabla 2. Probabilidad de disbiosis asociada a antibióticos por familia
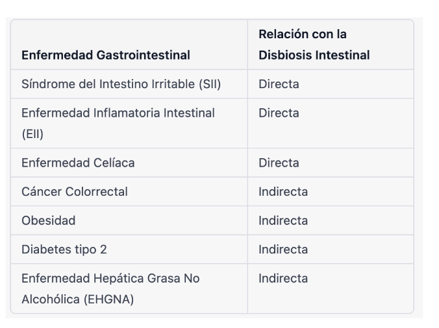
Tabla 3. Relación entre disbiosis intestinal y enfermedades gastrointestinales
Mecanismos fisiopatológicos de la disbiosis intestinal inducida por antibióticos
El uso de antibióticos puede alterar el equilibrio de la microbiota intestinal, afectando la salud digestiva e inmunológica. A continuación, se describe el proceso mediante el cual la disbiosis intestinal se desarrolla y sus consecuencias en el organismo:
-
El tratamiento con antibióticos mata tanto bacterias patógenas como beneficiosas en el tracto gastrointestinal.
-
La disbiosis intestinal altera la integridad de la barrera intestinal y su permeabilidad, permitiendo el paso de toxinas y antígenos alimentarios al torrente sanguíneo.
-
La disminución de la diversidad bacteriana reduce la producción de ácidos grasos de cadena corta, esenciales para la salud del epitelio intestinal y la regulación de la respuesta inmune.
-
El sistema inmunológico reconoce estos antígenos como extraños, desencadenando una respuesta inmune innata y adaptativa, que puede ser exacerbada por la disbiosis intestinal.
-
La respuesta inmune puede derivar en inflamación crónica de bajo grado y liberación de citoquinas proinflamatorias, aumentando el riesgo de inflamación sistémica, enfermedades autoinmunitarias y alergias.
¿Cómo se produce la disbiosis intestinal por antibióticos?
La disbiosis intestinal asociada al uso de antibióticos se produce cuando los antibióticos alteran el equilibrio de la microbiota intestinal, permitiendo el crecimiento excesivo de bacterias patógenas. La microbiota intestinal es un complejo ecosistema de bacterias, hongos y virus que habitan en el intestino y cumplen funciones importantes en la digestión, absorción de nutrientes, desarrollo del sistema inmunológico y protección contra patógenos.
Los antibióticos, al eliminar selectivamente ciertas bacterias, pueden reducir la diversidad de la microbiota intestinal, permitiendo el crecimiento excesivo de bacterias patógenas, incluyendo Clostridium difficile, una bacteria asociada con diarrea y colitis pseudomembranosa. Además, la alteración de la microbiota intestinal puede afectar la producción de ácidos grasos de cadena corta, la producción de mucina y la integridad de la barrera intestinal, lo que puede llevar a inflamación y daño tisular.
La disbiosis intestinal asociada al uso de antibióticos puede manifestarse clínicamente con diarrea, dolor abdominal, flatulencia, distensión abdominal, fiebre y otros síntomas gastrointestinales. La gravedad de la disbiosis puede variar de leve a grave, dependiendo del tipo de antibiótico utilizado, la dosis, la duración del tratamiento y la susceptibilidad individual del paciente. Ver gráfica 2.
Tratamiento preventivo o curativo de la disbiosis intestinal por antibióticos
La intervención temprana y preferiblemente preventiva de la disbiosis intestinal trae consigo beneficios para el paciente. Entre los probióticos que han demostrado beneficios en la prevención y el tratamiento de la disbiosis se encuentran las cepas de Lactobacillus y Bifidobacterium. Estudios clínicos han demostrado que la suplementación con Lactobacillus rhamnosus GG puede reducir el riesgo de diarrea asociada a antibióticos en un 50%, mientras que la suplementación con Bifidobacterium bifidum y Lactobacillus acidophilus puede reducir el riesgo en un 40%.
Otra cepa de probióticos que ha mostrado beneficios es la Saccharomyces boulardii. Un estudio encontró que la suplementación con S. boulardii durante el tratamiento con antibióticos redujo la incidencia de diarrea asociada a antibióticos en un 56%.
En cuanto a la restauración de la microbiota intestinal después de un tratamiento con antibióticos, un estudio encontró que la suplementación con una combinación de Lactobacillus acidophilus y Bifidobacterium bifidum aumentó la diversidad de la microbiota intestinal en un 50% en comparación con el grupo de control.
Una revisión de estudios encontró que la suplementación con Lactobacillus y Bifidobacterium redujo significativamente los síntomas del síndrome del intestino irritable y mejoró la calidad de vida de los pacientes. Otro estudio encontró que la suplementación con una combinación de Lactobacillus plantarum, Lactobacillus acidophilus, Bifidobacterium lactis y Bifidobacterium bifidum redujo la inflamación en pacientes con enfermedad inflamatoria intestinal.
En general, respecto a la disbiosis asociada a antibióticos hay dos acciones principales:
- Reducir la prescripción de antibióticos indiscriminada
- Prescribir probióticos como medida preventiva y terapéutica en pacientes en los que se requiere el tratamiento antibiótico
Ahora le preguntamos, ¿cuáles son las bacterias más resistentes a los antibióticos y cómo lo han conseguido? ¿Cuáles son los parámetros farmacológicos para el uso de los antibióticos?, las respuestas a este muchas otras preguntas te las damos en la conferencia: Resistencia bacteriana: entenderla y prevenirla
Referencias
- Huttenhower, C.; Gevers, D.; Knight, R.; Abubucker, S.; Badger, J.H.; Chinwalla, A.T.; Creasy, H.H.; Earl, A.M.; FitzGerald, M.G.; Fulton, R.S.; et al. Structure, function and diversity of the healthy human microbiome. Nature 2012, 486, 207–214.
- Fujimura, K.E.; Slusher, N.A.; Cabana, M.D.; Lynch, S.V. Role of the gut microbiota in defining human health. Expert Rev. Anti Infect. Ther. 2010, 8, 435–454
- Prosberg, M.; Bendtsen, F.; Vind, I.; Petersen, A.M.; Gluud, L.L. The association between the gut microbiota and the inflammatory bowel disease activity: A systematic review and meta-analysis. Scand. J. Gastroenterol. 2016, 51, 1407–1415.
- Levy, M.; Kolodziejczyk, A.A.; Thaiss, C.A.; Elinav, E. Dysbiosis and the immune system. Nat. Rev. Immunol. 2017, 17, 219-232.
- Modi, S.R.; Collins, J.J.; Relman, D.A. Antibiotics and the gut microbiota. J. Clin. Investig. 2014, 124, 4212-4218.
- Shi Y, Luo J, Narbad A, Chen Q. Advances in Lactobacillus Restoration for β-Lactam Antibiotic-Induced Dysbiosis: A System Review in Intestinal Microbiota and Immune Homeostasis. Microorganisms. 2023 Jan 11;11(1):179.
.png?width=200&height=63&name=Logo%20Legrand%20NUEVO%20(png).png)

.webp?width=369&height=250&name=Antibi%C3%B3ticos%20(1).webp)

